Zawartość
PH roztworu jest miarą jonów wodoru lub protonów obecnych w tym roztworze. Ponieważ kwasy są donorami protonów, na co dzień można powiedzieć, że roztwór zawierający „silny kwas” (to znaczy kwas o wysokiej skłonności do oddawania protonów) jest „bardziej kwaśny”. Roztwór składający się z pewnego stężenia silnego kwasu HCl, kwasu chlorowodorowego, będzie „bardziej kwaśny” niż roztwór zawierający podobne stężenie kwasu octowego lub zwykłego octu. Pod względem chemicznym dzieje się tak, ponieważ pH kwasu chlorowodorowego jest niższe.
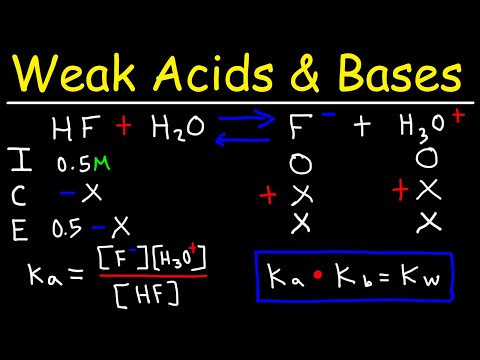
Możesz zapisać niezdysocjowany kwas schematycznie jako HA lub możesz zapisać jego składniki w roztworze jako H + (proton) i A- (koniugat kwasu). Na przykład kwas mrówkowy (występujący w jadu mrówek) to HCOOH, ale jego składnikami są H + i COOH-. Co ważne, gdy ten stosunkowo słaby kwas rozpuszcza się w roztworze, wszystkie trzy cząsteczki występują w różnych proporcjach. Stopień, w jakim jakikolwiek kwas wydziela protony, to stopień, w jakim jest zjonizowany, i jest to funkcja właściwości kwasu znanego jako jego Kza, które można znaleźć w tabelach online lub w książkach.
Procent jonizacji kwasu można obliczyć na podstawie jego pH w następujący sposób:
Krok 1: Przelicz pH na
pH definiuje się jako -log, gdzie jest stężenie protonów w roztworze w molach na litr, tj. jego molarność.
Jeśli na przykład masz 0,1 M roztwór kwasu mrówkowego o pH 2,5, możesz zastąpić tę wartość równaniem pH:
2,5 = -log
= 1 ÷ 102.5 = 0,00316 M = 3,16 × 10-3 mol / L = 3,16 mmol / L
Krok 2: Ustal
Aby uzyskać mocniejsze kwasy, potrzebujesz Kza kwasu, aby rozwiązać równanie:
K.za = ÷ ( - )
Jak wspomniano, możesz sprawdzić Kza wartości wielu pospolitych kwasów zamiast ich jednoznacznego obliczenia.
Ale w przypadku słabych kwasów, które stanowią większość tych problemów, =, a (-) jest bardzo blisko. Dlatego po prostu używasz molarności przewidzianego rozwiązania, która w tym przypadku wynosi 0,10.
Krok 3: Oblicz procent jonizacji
To jest / × 100, lub dla tego roztworu kwasu mrówkowego
(0.00316 ÷ 0.10) × 100
= 3.16 %