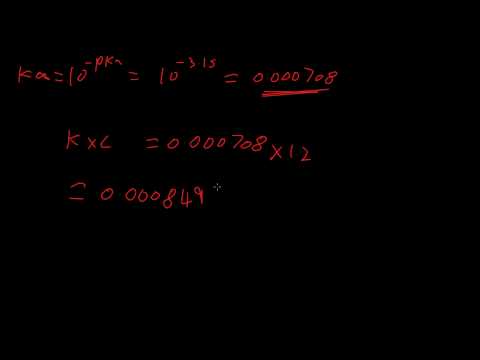
Zawartość
Siła kwasu jest mierzona zarówno przez jego pH, jak i jego pKa, a oba są powiązane równaniem Hendersona-Hasslebalcha. To równanie jest następujące: pH = pKa + log /, gdzie jest stężenie kwasu i stężenie jego sprzężonej zasady po dysocjacji. pH jest zmienną, która zależy od stężenia, więc jeśli chcesz czerpać jego wartość z tej zależności, musisz znać stężenia kwasu i jego sprzężonej zasady.
Jakie są pH i pKa?
Akronim pH oznacza „moc wodoru” i jest miarą stężenia jonów wodoru w roztworze wodnym. Poniższe równanie wyraża tę zależność:
pH = -log
Z drugiej strony wartość pKa zależy od stężenia kwasu i sprzężonej zasady w roztworze po osiągnięciu równowagi dysocjacji kwasu. Stosunek stężeń sprzężonej zasady i sprzężonego kwasu do danego kwasu w roztworze wodnym nazywa się stałą dysocjacji Ka. Wartość pKa jest określona przez:
pKa = -log (Ka)
Chociaż pH zmienia się w zależności od roztworu, pKa jest stałą dla każdego kwasu.
Równanie Hendersona-Hasselbalcha
Wzór Hendersona-Hasselbalcha pochodzi bezpośrednio z definicji stałej dysocjacji Ka. Dla kwasowego HA, który dysocjuje na H+ i A- w wodzie stała dysocjacji jest dana przez:
Ka = /
Możemy przyjąć logarytm obu stron:
log (Ka) = log (/) lub log Ka = log (H +) + log /
Odnosząc się do definicji pH i pKa, staje się to:
-pKa = -pH + log /
Wreszcie, po dodaniu pH i pKa po obu stronach:
pH = pKa + log /.
To równanie pozwala obliczyć pH, jeśli znana jest stała dysocjacji, pKa oraz stężenia kwasu i zasady sprzężonej.