Zawartość
Kiedy związek jonowy rozpuszcza się, rozdziela się na jony składowe. Każdy z tych jonów zostaje otoczony przez cząsteczki rozpuszczalnika, proces zwany solwatacją. W konsekwencji związek jonowy wnosi do roztworu więcej cząstek niż związek cząsteczkowy, który nie dysocjuje w ten sposób. Osmolarność jest przydatna do określania ciśnienia osmotycznego.
Molarność vs. osmolarność
Chemicy zwykle opisują stężenie w kategoriach molarności, gdzie mol to 6,022 x 10 ^ 23 cząstek, jonów lub cząsteczek, a jeden molowy roztwór ma jeden mol substancji rozpuszczonej na litr roztworu. Jeden molowy roztwór NaCl zawierałby jeden mol jednostek wzoru NaCl. Ponieważ NaCl dysocjuje w wodzie na jony Na + i Cl-, roztwór tak naprawdę zawiera dwa mole jonów: jeden mol jonów Na + i jeden mol jonów Cl-. Aby odróżnić ten pomiar od molarności, chemicy nazywają go osmolarnością; jedno molowy roztwór soli ma dwa osmolarne pod względem stężenia jonów.
Czynniki
Najważniejszym czynnikiem określającym osmolarność jest molarność roztworu - im więcej moli substancji rozpuszczonej, tym więcej osmoli jonów jest obecnych. Innym ważnym czynnikiem jest jednak liczba jonów, na które dysocjuje związek. NaCl dysocjuje na dwa jony, ale chlorek wapnia (CaCl2) dysocjuje na trzy: jeden jon wapnia i dwa jony chlorkowe. W związku z tym, wszystko inne jest równe, roztwór chlorku wapnia będzie miał wyższą osmolarność niż roztwór chlorku sodu.
Odchylenie od idealności
Trzecim i ostatnim czynnikiem wpływającym na osmolarność jest odchylenie od idealności. Teoretycznie wszystkie związki jonowe powinny całkowicie się dysocjować. W rzeczywistości jednak niewielka część związku pozostaje niezdysocjowana. Większość chlorku sodu rozpada się na jony sodu i chloru w wodzie, ale niewielka część pozostaje związana razem jako NaCl. Ilość niezdysocjowanego związku wzrasta wraz ze wzrostem stężenia związku, więc ten czynnik może stać się bardziej znaczącym problemem przy wyższych stężeniach. W przypadku niskich stężeń substancji rozpuszczonej odchylenie od idealizmu jest znikome.
Znaczenie
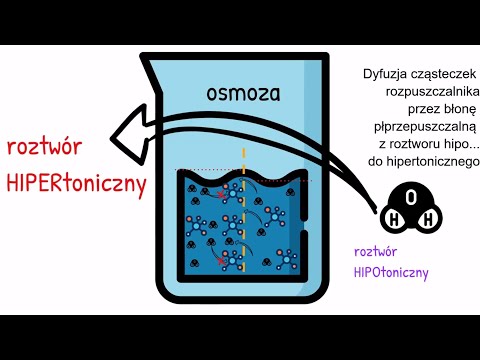
Osmolarność jest ważna, ponieważ determinuje ciśnienie osmotyczne. Jeśli roztwór zostanie oddzielony od innego roztworu o różnym stężeniu przez półprzepuszczalną membranę, a jeśli półprzepuszczalna membrana pozwoli na przejście cząsteczek wody, ale nie jonów, woda dyfunduje przez membranę w kierunku rosnącego stężenia. Ten proces nazywa się osmozą. Błony komórek w twoim ciele działają jak błony półprzepuszczalne, ponieważ woda może je przenikać, ale jony nie. Dlatego lekarze używają roztworu soli fizjologicznej do infuzji IV, a nie czystej wody; jeśli użyliby czystej wody, osmolarność krwi zmniejszyłaby się, powodując, że komórki takie jak krwinki czerwone pobierają wodę i pękają.