Zawartość
Enzymy są krytycznymi cząsteczkami białkowymi w żywych układach, które po zsyntetyzowaniu zwykle nie są przekształcane w inne cząsteczki, podobnie jak substancje przyjmowane jako paliwo w procesach trawiennych i oddechowych (np. Cukry, tłuszcze, tlen cząsteczkowy). To dlatego, że enzymy są katalizatory, co oznacza, że mogą brać udział w reakcjach chemicznych bez zmiany siebie, trochę jak moderator publicznej debaty, który idealnie prowadzi uczestników i publiczność do zakończenia, dyktując warunki sporu, nie dodając żadnych unikalnych informacji.
Zidentyfikowano ponad 2000 enzymów i każdy z nich bierze udział w jednej konkretnej reakcji chemicznej. Enzymy są zatem specyficzne dla substratu. Są one podzielone na pół tuzina klas na podstawie rodzajów reakcji, w których biorą udział.
Podstawy enzymów
Enzymy pozwalają na wiele reakcji zachodzących w ciele w warunkach homeostazalub ogólna równowaga biochemiczna. Na przykład wiele enzymów działa najlepiej na poziomie pH (kwasowości) zbliżonym do pH, które normalnie utrzymuje ciało, które jest w zakresie 7 (to znaczy nie jest zasadowe ani kwasowe). Inne enzymy działają najlepiej przy niskim pH (wysokiej kwasowości) ze względu na wymagania środowiska; na przykład wnętrze żołądka, w którym działają niektóre enzymy trawienne, jest bardzo kwaśne.
Enzymy biorą udział w procesach od krzepnięcia krwi, syntezy DNA po trawienie. Niektóre znajdują się tylko w komórkach i biorą udział w procesach z udziałem małych cząsteczek, takich jak glikoliza; inne są wydzielane bezpośrednio do jelit i działają na substancje masowe, takie jak połykane jedzenie.
Ponieważ enzymy są białkami o dość wysokich masach cząsteczkowych, każdy z nich ma wyraźny trójwymiarowy kształt. To określa konkretne cząsteczki, na które działają. Oprócz zależności od pH, kształt większości enzymów zależy od temperatury, co oznacza, że działają one najlepiej w dość wąskim zakresie temperatur.
Jak działają enzymy
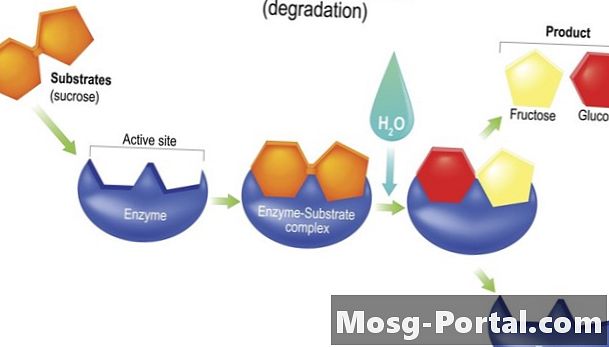
Większość enzymów działa poprzez obniżenie energia aktywacji reakcji chemicznej. Czasami ich kształt sprawia, że reagenty są fizycznie blisko siebie, na przykład w stylu trenera drużyny sportowej lub kierownika grupy roboczej, który chce szybciej wykonać zadanie. Uważa się, że gdy enzymy wiążą się z reagentem, ich kształt zmienia się w sposób, który destabilizuje reagent i czyni go bardziej podatnym na wszelkie zmiany chemiczne związane z reakcją.
Reakcje, które mogą przebiegać bez wkładu energii, nazywane są reakcjami egzotermicznymi. W tych reakcjach produkty lub substancje chemiczne powstałe podczas reakcji mają niższy poziom energii niż substancje chemiczne, które służą jako składniki reakcji. W ten sposób cząsteczki, takie jak woda, „szukają” własnego poziomu (energii); atomy „wolą” być w układach o niższej całkowitej energii, tak jak woda płynie w dół do najniższego dostępnego punktu fizycznego. Podsumowując, wszystko jest jasne, że reakcje egzotermiczne zawsze przebiegają naturalnie.
Jednak fakt, że reakcja nastąpi nawet bez wkładu, nie mówi nic o szybkości, z jaką ona nastąpi. Jeśli substancja pobrana do organizmu zmieni się naturalnie w dwie substancje pochodne, które mogą służyć jako bezpośrednie źródła energii komórkowej, nie przyniesie to wiele korzyści, jeśli reakcja zajmie w naturalny sposób godziny lub dni. Także, nawet gdy całkowita energia produktów jest wyższa niż energii reagentów, ścieżka energii nie jest gładkim zjazdem na wykresie; zamiast tego produkty muszą osiągnąć wyższy poziom energii niż ten, z którym się rozpoczęły, aby mogły „przejść przez garb” i reakcja mogła przebiegać. Ta wstępna inwestycja energii w reagenty, która się opłaca w postaci produktów, jest wspomniana powyżej energia aktywacji, Rudaza.
Rodzaje enzymów
Ciało ludzkie obejmuje sześć głównych grup lub klas enzymów.
Oksydoreduktazy zwiększyć szybkość reakcji utleniania i redukcji. W tych reakcjach, zwanych także reakcjami redoks, jeden z reagentów oddaje parę elektronów, którą otrzymuje drugi reagent. Mówi się, że donor pary elektronów jest utleniony i działa jako czynnik redukujący, podczas gdy odbiorca pary elektronów jest zmniejszony, nazywany jest czynnikiem utleniającym. Prostszym sposobem na określenie tego jest to, że w tego rodzaju reakcjach poruszają się atomy tlenu, atomy wodoru lub oba. Przykłady obejmują oksydazę cytochromową i dehydrogenazę mleczanową.
Transferazy prędkość wzdłuż transferu grup atomów, takich jak metyl (CH3), acetyl (CH3CO) lub amino (NH2), od jednej cząsteczki do drugiej cząsteczki. Kinaza octanowa i deaminaza alaninowa są przykładami transferaz.
Hydrolazy przyspieszyć reakcje hydrolizy. Reakcje hydrolizy wykorzystują wodę (H2O) rozszczepienie wiązania w cząsteczce w celu wytworzenia dwóch produktów pochodnych, zwykle poprzez przymocowanie -OH (grupy hydroksylowej) z wody do jednego z produktów i pojedynczego -H (atom wodoru) do drugiego. Tymczasem z atomów wypartych przez składniki -H i -OH powstaje nowa cząsteczka. Enzymy trawienne lipaza i sukraza są hydrolazami.
Lyases zwiększyć szybkość dodawania jednej grupy molekularnej do podwójnego wiązania lub usuwania dwóch grup z pobliskich atomów w celu utworzenia podwójnego wiązania. Działają one jak hydrolazy, z tym wyjątkiem, że usunięty składnik nie jest wypierany przez wodę lub porcje wody. Ta klasa enzymów obejmuje dekarboksylazę szczawianową i liazę izokrylanową.
Izomerazy przyspieszenie reakcji izomeryzacji. Są to reakcje, w których wszystkie pierwotne atomy w reagencie są zatrzymywane, ale są przegrupowane z utworzeniem izomeru reagenta. (Izomery są cząsteczkami o tym samym wzorze chemicznym, ale różnych układach.) Przykłady obejmują izomerazę glukozo-fosforanową i racemazę alaninową.
Ligazy (zwane także syntetazami) zwiększają szybkość łączenia dwóch cząsteczek. Zazwyczaj dokonują tego, wykorzystując energię pochodzącą z rozpadu adenozynotrifosforanu (ATP). Przykłady ligaz obejmują syntetazę acetylo-CoA i ligazę DNA.
Hamowanie enzymów
Oprócz zmian temperatury i pH inne czynniki mogą powodować zmniejszenie lub wyłączenie aktywności enzymów. W procesie zwanym interakcją allosteryczną kształt enzymu zostaje tymczasowo zmieniony, gdy cząsteczka wiąże się z jej częścią poza miejscem, w którym łączy się z reagentem. Prowadzi to do utraty funkcji. Czasami jest to przydatne, gdy sam produkt służy jako inhibitor allosteryczny, ponieważ zwykle jest to znak, że reakcja przeszła do punktu, w którym dodatkowy produkt nie jest już potrzebny.
W hamowaniu konkurencyjnym substancja zwana związkiem regulacyjnym konkuruje z reagentem o miejsce wiązania. Jest to podobne do próby włożenia kilku działających kluczy do tej samej blokady w tym samym czasie. Jeśli wystarczająca ilość tych związków regulatorowych połączy się z wystarczająco wysoką obecnością enzymu, spowalnia lub zamyka szlak reakcji. Może to być pomocne w farmakologii, ponieważ mikrobiologowie mogą projektować związki, które konkurują z miejscami wiązania enzymów bakteryjnych, co znacznie utrudnia bakteriom wywoływanie choroby lub przeżycie w organizmie ludzkim.
W przypadku niekonkurencyjnego hamowania cząsteczka hamująca wiąże się z enzymem w miejscu innym niż miejsce aktywne, podobnie jak w przypadku interakcji allosterycznej. Nieodwracalne hamowanie występuje, gdy inhibitor trwale wiąże się z enzymem lub znacząco go degraduje, tak że jego funkcja nie może się zregenerować. Zarówno gaz nerwowy, jak i penicylina wykorzystują ten rodzaj hamowania, aczkolwiek z myślą o bardzo różnych intencjach.