Zawartość
Stężenie roztworu reprezentuje jego moc lub słabość. Na co dzień wyrażasz koncentrację jako procent - na przykład w aptece możesz kupić 35 procent alkoholu do wycierania. Jednak w chemii stężenie wyraża się zwykle w postaci „molowości” - „moli” substancji rozpuszczonej na litr wody. Gdy poznasz roztwory rozpoczynające molarność - jego „początkowe stężenie” - możesz użyć prostego równania, aby obliczyć, jaka byłaby molarność, gdyby rozcieńczono go do określonej objętości - jego „końcowe stężenie”.
Zamień swoje gramy substancji rozpuszczonej w mole, pamiętając, że jeden mol substancji jest równy jej masie cząsteczkowej (w jednostkach masy atomowej „amu”) przedstawionej w gramach. Jako przykład rozważmy 124,5 g węglanu wapnia, CaCO3. Zgodnie z układem okresowym masa cząsteczkowa węglanów wapnia wynosi 100,09 amu, co oznacza, że jej „masa molowa” wynosi 100,09 gramów. Obliczyć mole, stosując następujący współczynnik przeliczeniowy: 124 g CaCO3 X (1 mol CaCO3 / 100,09 g CaCO3) = 1,24 mol CaCO3.
Oblicz molarność - mole substancji rozpuszczonej na litr rozpuszczalnika. Wyobraź sobie na przykład, że chcesz rozpuścić 124,5 g CaCO3 w dwóch litrach wody. Podziel mole substancji rozpuszczonej przez litry rozpuszczalnika - w tym przypadku wody - aby wyliczyć molarność. 124,5 gramów węglanu wapnia - 1,24 mol CaCO3 - rozpuszczony w dwóch litrach wody ma stężenie 0,62 mola na litr lub 0,62 M.
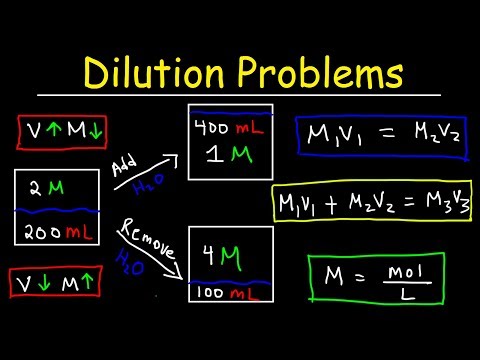
Wprowadź swoje wartości do „Równania rozcieńczenia”, Ci x Vi = Cf x Vf, gdzie „C” i „V” oznaczają „stężenie” (w molach na litr) i „objętość” (w litrach) oraz „i” i „ f „reprezentują odpowiednio„ początkowy ”i„ końcowy ”. Wyobraź sobie, że chcesz rozcieńczyć roztwór węglanu wapnia do objętości 3,5 litra. W tym przypadku (.62) (2) = (Cf) (3.5), 1,24 = 3,5 (Cf) i 1,24 / 3,5 = Cf. Stąd końcowe stężenie wynosi 0,35 M.