Zawartość
Reakcje neutralizacji zachodzą, gdy łączysz ze sobą dwie niezwykle reaktywne substancje w celu uczynienia ich nieaktywnymi lub neutralnymi. Na przykład połączenie kwasu i zasady razem daje wodę. Reakcje neutralizacji wydzielają energię, która jest znana jako ciepło neutralizacji. Ciepło molowe neutralizacji to ilość ciepła, jaką każdy mol zasady dodanej do kwasu (lub odwrotnie) powoduje wydzielanie się reakcji. (Kret jest jednostką używaną przez chemików do reprezentowania dużej liczby cząsteczek.) Po określeniu, jaka zachodzi zmiana temperatury, reszta jest prosta.
Zważ swój kwas na wadze elektronicznej. Połóż pustą zlewkę na wadze i naciśnij przycisk Tara, aby anulować wagę zlewki, a następnie wlej kwas do zlewki i umieść ją na wadze. Zapisz masę swojego kwasu.
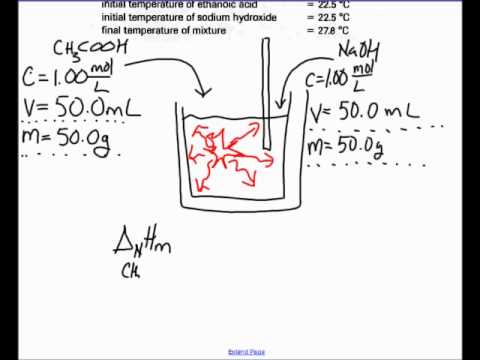
Obliczyć zmianę temperatury występującą podczas reakcji za pomocą kalorymetru, urządzenia, które zarówno mierzy temperaturę, jak i utrzymuje reagent. Dodaj bazę do kalorymetru i umieść kwas (w zlewce) poniżej ust kalorymetrów. Włóż termometr kalorymetrowy do kwasu i odczytaj temperaturę początkową. Dodaj ilość zasady, którą określa twoja reakcja do kwasu, a następnie przeczytaj kalorymetr, aby określić zmianę temperatury.
Obliczyć ciepło zobojętnienia przy pomocy wzoru Q = mcΔT, gdzie „Q” oznacza ciepło zobojętnienia, „m” to masa twojego kwasu, „c” to właściwa pojemność cieplna roztworów wodnych, 4,1814 dżuli (gram x ° C), a „ΔT” to zmiana temperatury mierzona za pomocą kalorymetru. Na przykład, jeśli zaczniesz od 34,5 g kwasu chlorowodorowego w 26 ° C i jego temperatura wzrośnie do 29,1 ° C po dodaniu do niego wodorotlenku sodu, oblicz ciepło neutralizacji w następujący sposób: Q = mcΔT = (34,5 gx 4,1814 J) ÷ ((gx ° C) x 3,1 ° C) = 447,48 dżuli.
Oblicz liczbę moli dodanej zasady, aby określić ciepło molowe neutralizacji, wyrażone za pomocą równania HH = Q ÷ n, gdzie „n” oznacza liczbę moli. Załóżmy na przykład, że dodajesz 25 ml 1,0 M NaOH do HCl, aby wytworzyć ciepło neutralizacji 447,78 dżuli. (Należy pamiętać, że 1,0 M oznacza jeden mol na litr.) Ponieważ dodałeś 25 ml (25/1000 lub 0,025 L) NaOH, określ mole w następujący sposób: 1,0 mol / L x 0,025 L = 0,025 mol. W tym przykładzie ciepło molowe neutralizacji ΔH wynosi 447,48 dżuli na 0,025 mola dodanego NaOH - 447,48 / .025 lub 17 900 dżuli na mol.