Zawartość
- TL; DR (Too Long; Didnt Read)
- Hybrydyzowane orbitale
- Hybrydyzacja Sp
- Hybrydyzacja Sp2
- Hybrydyzacja Sp3
- Wyższe liczby steryczne
Przewiduj kąty między związanymi atomami, stosując teorię odpychania pary elektronów z powłoką walencyjną (VSEPR). Liczba steryczna - suma innych atomów i pojedynczych par elektronów związanych z atomem centralnym - określa geometrię cząsteczki. Samotne pary elektronów znajdują się w zewnętrznej (walencyjnej) powłoce atomu i nie są dzielone z innymi atomami.
TL; DR (Too Long; Didnt Read)
Chociaż nie można użyć VSEPR do obliczenia kątów wiązania, pomaga określić te kąty na podstawie liczby sterycznej. Tylko wodór ma liczbę steryczną jeden, a cząsteczka H2 ma kształt liniowy.
Hybrydyzowane orbitale
Elektron krąży wokół atomu w charakterystycznym kształcie określonym przez najbardziej prawdopodobne miejsce znalezienia elektronu w dowolnym momencie. Elektrony odpychają się nawzajem, ponieważ wszystkie mają ładunki ujemne, więc orbity dają każdemu elektronowi maksymalną możliwą odległość od swoich sąsiadów. Kiedy elektron walencyjny tworzy wiązanie kowalencyjne z innym atomem, orbita zmienia się w procesie zwanym hybrydyzacją. VSEPR przewiduje kąty wiązania na podstawie hybrydyzowanych orbitali, ale nie jest dokładny dla niektórych związków metali, soli gazowych i tlenków.
Hybrydyzacja Sp
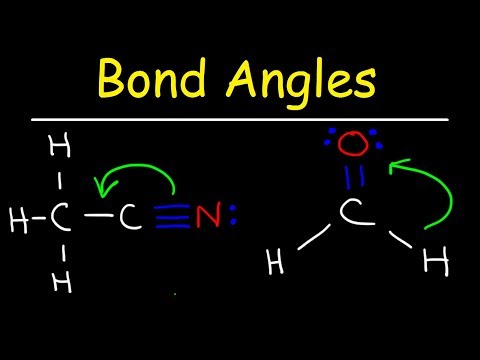
Najprostszym orbitalem hybrydowym jest sp, odpowiadający sterycznej liczbie dwóch. Kąt wiązania jest liniowy lub 180 stopni, gdy atom nie ma pojedynczych par elektronów. Przykładem jest dwutlenek węgla. I odwrotnie, cząsteczka azotu ma jedną samotną parę elektronów. To daje mu liniowy kształt, ale niezhybrydyzowaną orbitę, a zatem nie ma kąta wiązania.
Hybrydyzacja Sp2
Liczba steryczna trzech prowadzi do tworzenia orbitali sp2. Kąty wiązania zależą od liczby pojedynczych par elektronów. Na przykład trójchlorek boru nie ma pojedynczych par, trójwymiarowego płaskiego kształtu i kątów wiązania 120 stopni. Cząsteczka trójtlenowa O3 ma jedną samotną parę i tworzy zgięty kształt z kątami wiązania 118 stopni. Z drugiej strony O2 ma dwie samotne pary i liniowy kształt.
Hybrydyzacja Sp3
Atom o liczbie sterycznej czterech może mieć od zera do trzech samotnych par elektronów w orbicie zhybrydyzowanej sp3. Metan, który nie ma pojedynczych par, tworzy czworościan o kątach wiązania 109,5 stopnia. Amoniak ma jedną samotną parę, tworząc kąty wiązania 107,5 stopnia i trójkątny kształt piramidy. Woda z dwiema samotnymi parami elektronów ma wygięty kształt z kątami wiązania 104,5 stopnia. Cząsteczki fluoru mają trzy pojedyncze pary i geometrię liniową.
Wyższe liczby steryczne
Wyższe liczby steryczne prowadzą do bardziej złożonych geometrii i różnych kątów wiązania. Oprócz VSEPR skomplikowane teorie, takie jak pola sił molekularnych i teoria kwantowa, przewidują również kąty wiązania.