Zawartość
Określając ładunek formalny cząsteczki, takiej jak CoCl2 (gaz fosgenowy), musisz znać liczbę elektronów walencyjnych dla każdego atomu i strukturę Lewisa cząsteczki.
Wartość elektronowa walencyjna
Wyszukaj każdy atom w układzie okresowym pierwiastków, aby określić liczbę elektronów walencyjnych.
Pamiętaj, że dwa elektrony idą w powłoce pierwszej s, dwa elektrony w powłoce drugiej s, sześć elektronów w pierwszej powłoce p itp. Dla przypomnienia: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s ( ^ 2) 3p (^ 6)
Dostosuj do ładowania. Jeśli cząsteczką jest jon, dodaj lub odejmij jeden lub więcej elektronów ogółem, aby uwzględnić ładunek końcowy.
Dla CoCl2 (gaz fosgenowy): C = 4; O = 6; Cl = 7. Cząsteczka nie jest zjonizowana i ma ładunek neutralny. Dlatego całkowita ilość elektronów walencyjnych wynosi 4 + 6 + (7x2) = 24.
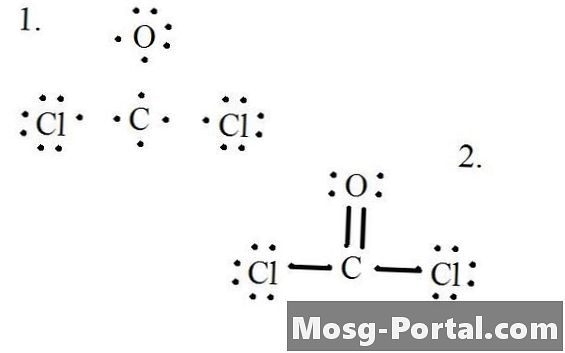
Struktura Lewisa
Zobacz schemat struktury Lewisa CoCl2 (gaz fosgenowy). Struktura Lewisa reprezentuje najbardziej stabilną i prawdopodobną strukturę cząsteczki. Atomy są rysowane za pomocą sparowanych elektronów walencyjnych; wiązania tworzą się między pojedynczymi elektronami, aby spełnić zasadę oktetu.