Zawartość
Cząstki subatomowe to pojedyncze protony, neutrony i elektrony, które składają się na skład atomów. Za pomocą układu okresowego pierwiastków możemy obliczyć, ile cząstek subatomowych znajduje się w danym atomie. Protony i neutrony znajdują się w jądrze atomu, podczas gdy elektrony otaczają jądro. Masę atomową lub liczbę masową podaje się zwykle w postaci dziesiętnej, ze względu na liczbę znalezionych izotopów i ich względną obfitość. Niektóre znane izotopy mają określoną liczbę neutronów i są pomocne w rozmowach o materiałach radioaktywnych.
Podstawowe obliczenia subatomowe
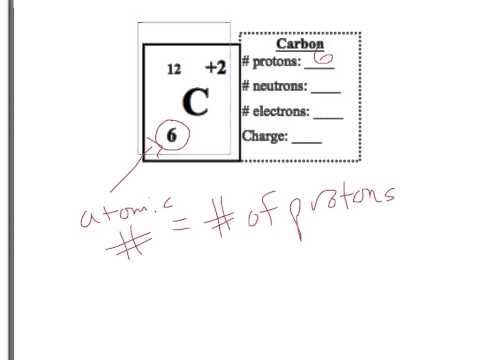
Znajdź liczbę atomową danego elementu na układzie okresowym; jest to liczba protonów znajdujących się w jądrze. Zazwyczaj jest wymieniony powyżej symbolu elementu. Tożsamość elementu opiera się na liczbie protonów znalezionych w jądrze.
Określ liczbę elektronów za pomocą liczby atomowej. Atom ma ładunek neutralny, więc ładunki dodatnie i ujemne są sobie równe. Liczba atomowa jest także liczbą elektronów.
Oblicz liczbę neutronów, biorąc liczbę masową i odejmując liczbę protonów znajdujących się w jądrze. Liczba masowa zwykle znajduje się poniżej symbolu elementu i reprezentuje, ile element ważyłby w gramach, biorąc pod uwagę mol substancji. Ponieważ masa jest scentralizowana w jądrze, tylko protony i neutrony przyczyniają się do liczby masowej.
Obliczenia izotopowe
Znajdź liczbę atomową liczby protonów i elektronów w atomie w układzie okresowym pierwiastków. Liczba protonów i elektronów jest równa liczbie atomowej.
Oblicz liczbę neutronów, odejmując liczbę atomową od liczby izotopowej. Na przykład węgiel 14 ma masę izotopową 14 i 6 protonów, więc liczba neutronów wynosi 8.
Izotopy to pierwiastki różniące się masą. Ponieważ masa pochodzi z jądra, a protony podają tożsamość pierwiastka, liczba neutronów różni się w izotopach.