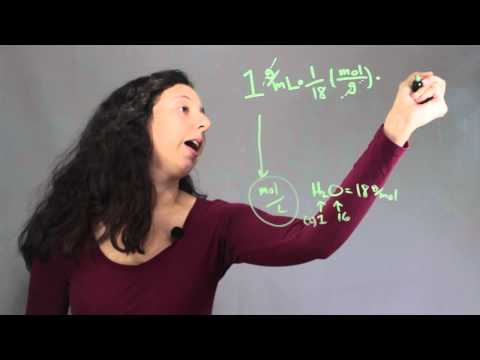
Zawartość
- TL; DR (Too Long; Didnt Read)
- Definiowanie kretka i molarności
- Konwersja molarności na gęstość
- Konwersja gęstości na molarność
Molarność i gęstość to różne sposoby wyrażania zasadniczo tego samego. Podczas gdy gęstość jest masą ciała stałego, cieczy lub gazu podzieloną przez jej objętość, molarność jest liczbą moli substancji rozpuszczonej na litr roztworu. Mol związku jest masą atomową atomów składowych w gramach, a litr jest miarą objętości, więc molarność jest również miarą gęstości. Chemicy wolą stosować molarność, ponieważ pozwala ona na zastosowanie wielu równań, takich jak prawo gazu doskonałego, w szerszych okolicznościach. Ułatwia to niektóre obliczenia, jeśli wszystkie wielkości są w jednostkach gęstości.
TL; DR (Too Long; Didnt Read)
Molarność to liczba moli substancji rozpuszczonej na litr roztworu. Przelicz na gęstość poprzez pomnożenie liczby moli przez masę cząsteczkową związku. Przelicz gęstość na molarność, przeliczając ją na gramy na litr i dzieląc przez masę cząsteczkową związku w gramach.
Definiowanie kretka i molarności
Kret jest jednostką używaną przez chemików do mierzenia masy. Mol dowolnego związku ma dokładnie taką samą liczbę cząstek jak 12 gramów węgla-12, co jest liczbą Avogadrosa (6,02 x 1023) cząstek. Masa tej samej liczby cząstek dowolnego związku zależy od mas atomowych atomów, które go tworzą. Na przykład. mol wodoru gazowego (H2) ma masę 2,016 gramów, ponieważ średnia masa atomowa wszystkich izotopów wodoru wynosi 1,008 AMU (jednostki masy atomowej). Podobnie, mol metanu gazowego (CH4) ma masę 16,043 gramów, ponieważ masa węgla, biorąc pod uwagę wszystkie jego naturalnie występujące izotopy, wynosi 12,011.
Chemicy używają molarności do pomiaru stężenia substancji rozpuszczonej w roztworze. Molarność (M) to liczba moli substancji rozpuszczonej w litrze roztworu. Chlorek sodu (NaCl) ma masę cząsteczkową (22,99 + 35,45) = 58,44 AMU, więc jeśli rozpuszczasz 58,44 grama soli kuchennej w litrze wody, masz 1 M (1 molowy) roztwór.
Konwersja molarności na gęstość
Molarność substancji rozpuszczonej jest miarą gęstości tej substancji rozpuszczonej i dość łatwo obliczasz jedną z drugiej. Rozważ przykład 1 M roztworu NaCl. Zawiera 58,44 grama NaCl na litr roztworu, więc gęstość NaCl w roztworze wynosi 58,44 grama / litr. Jeśli zamiast tego masz 1,05 M roztwór NaCl, wystarczy pomnożyć molarność przez masę cząsteczkową NaCl, aby znaleźć gęstość w gramach na litr: (1,05 * 58,44) = 61,32 g / l. Obliczenia są zwykle łatwiejsze, jeśli zamienisz gęstość na gramy / mililitr, mnożąc wynik przez 10-3. Zatem 58,44 g / l staje się 0,05844 g / ml, a 61,32 g / l staje się 0,06132 g / ml.
Konwersja gęstości na molarność
Odwrotna procedura, przekształcająca gęstość substancji rozpuszczonej w roztworze na molarność, nie jest trudna. Przelicz gęstość substancji rozpuszczonej na gramy / litr, a następnie podziel wynik przez masę cząsteczkową substancji rozpuszczonej. Rozważmy na przykład roztwór, w którym gęstość chlorku sodu wynosi 0,036 g / ml. Pomnóż przez 103 przeliczone na g / l = 36 g / l. Podziel przez masę cząsteczkową NaCl (58,44 g): 36 g / l ÷ 58,44 g / mol = 6,16 mola / l = 0,62 M.