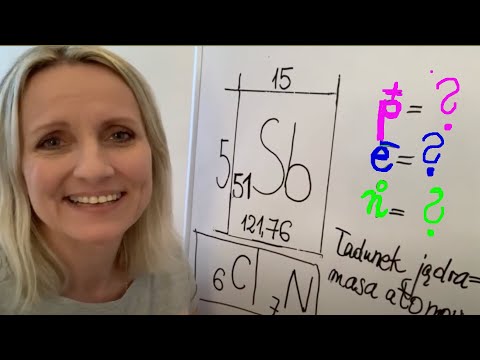
Zawartość
Atom jest podstawowym składnikiem materii, który składa się z dodatnio naładowanego rdzenia (jądra) otoczonego chmurą ujemnie naładowanych elektronów. Z definicji atomy są jednostkami neutralnymi, ponieważ ładunek dodatni jądra jest anulowany przez ładunek ujemny chmury elektronów. Jednak wzrost lub utrata elektronu może prowadzić do powstania jonu, znanego również jako atom naładowany.
Szarża żywiołów
Element jest przykładem atomu o ustalonej liczbie dodatnich protonów w jądrze. Na przykład sód jest pierwiastkiem z 11 protonami w jądrze i 11 elektronami. Innym przykładem pierwiastka jest węgiel, który ma sześć protonów w jądrze i sześć elektronów. W obu przypadkach elementy te mają ładunek neutralny. Atom zostaje naładowany, gdy liczba protonów nie jest równa liczbie elektronów. Na przykład, jeśli element ma sześć protonów, ale tylko pięć elektronów, ładunek netto elementu wynosi +1. I odwrotnie, jeśli element ma sześć protonów, ale siedem elektronów, wówczas ładunek netto elementu wynosi -1. W rzeczywistości wszystkie pierwiastki są neutralne w stanie naturalnym, a ich wzrost zależy od przyrostu lub utraty elektronów.
Orbity elektronów wokół jądra
Elektrony otaczające atomy mogą znajdować się tylko w ściśle określonych powłokach. Każda powłoka może pomieścić tylko określoną liczbę elektronów, a atomy są bardziej stabilne, gdy te powłoki są wypełnione. Można przewidzieć, jaki ładunek atom zyska, patrząc na to, jak elektrony siedzą wokół atomu. Pierwsza powłoka atomu może pomieścić tylko dwa elektrony, druga powłoka może pomieścić osiem elektronów, a trzecia powłoka może pomieścić 16 elektronów. Jeśli pocisk jest mniej niż w połowie pełny, atomowi łatwiej jest stracić elektrony, aby stać się bardziej stabilnym. W tym przypadku atom staje się jonem dodatnim. Alternatywnie, jeśli skorupa jest wypełniona w ponad połowie, atomowi łatwiej jest zdobyć elektrony, aby stać się bardziej stabilnym. Prowadzi to do jonu ujemnego.
Przykład - Sód
Sód ma 11 elektronów, które krążą wokół jądra. Pierwsze dwie skorupy w obrębie sodu są pełne, a trzeci elektron zajmuje tylko jeden elektron. Dlatego sodowi łatwiej jest stracić elektron i stać się dodatni.