Zawartość
- Okresowa organizacja
- Uzasadnienie naukowe
- Metale ziem alkalicznych i alkalicznych
- Metale przejściowe
- Metaloidy i niemetale
- Gazy szlachetne
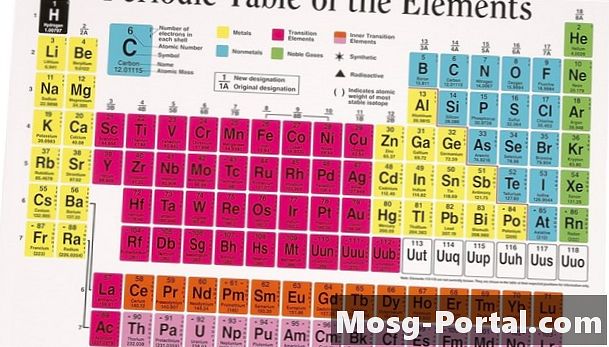
Układ okresowy, który zawiera wszystkie naturalnie występujące i szalone pierwiastki chemiczne, jest centralnym filarem każdej klasy chemicznej. Ta metoda klasyfikacji pochodzi z książki z 1869 roku, napisanej przez Dmitrija Iwanowicza Mendelejewa. Rosyjski naukowiec zauważył, że kiedy pisał znane pierwiastki w celu zwiększenia masy atomowej, mógł z łatwością posortować je w rzędy na podstawie podobnych cech. O dziwo podobieństwa były tak wyraźne, że Mendelejew był w stanie pozostawić miejsce dla kilku nieodkrytych elementów w swojej okresowej klasyfikacji.
Okresowa organizacja
W układzie okresowym element jest zdefiniowany przez jego grupę pionową i okres poziomy. Każdy okres, ponumerowany od jednego do siedmiu, zawiera elementy o rosnącej liczbie atomowej.W przeciwieństwie do oryginalnej listy Mendelejewa, nowoczesny układ okresowy opiera się na liczbie atomowej lub liczbie protonów w jądrze atomowym pierwiastków. Liczba protonów jest logicznym wyborem do organizowania pierwiastków, ponieważ protony określają chemiczną tożsamość atomu, podczas gdy masa atomowa zmienia się w zależności od różnych izotopów atomowych. Osiemnaście kolumn znajduje się w układzie okresowym, zwykle nazywanych grupami. Każda grupa zawiera kilka elementów, które mają podobne właściwości fizyczne ze względu na ich podstawową strukturę atomową.
Uzasadnienie naukowe
Atom to najmniejszy podział materii, który zachowuje swoją tożsamość jako pierwiastek chemiczny; jest z jądra centralnego otoczonego chmurą elektronową. Jądro ma ładunek dodatni dzięki protonom, które przyciągają małe, ujemnie naładowane elektrony. Elektrony i protony są równe pod względem liczby dla neutralnego atomu. Elektrony są zorganizowane w orbitale lub powłoki ze względu na zasady mechaniki kwantowej, które ograniczają liczbę elektronów w każdej powłoce. Oddziaływania chemiczne między atomami zwykle wpływają tylko na zewnętrzne elektrony w ostatniej powłoce, zwane elektronami walencyjnymi. Elementy w każdej grupie mają tę samą liczbę elektronów walencyjnych, co powoduje, że reagują one podobnie, gdy zyskują lub tracą elektrony do innych atomów. Powłoki elektronowe powiększają się, powodując wzrost wielkości okresowego układu okresowego.
Metale ziem alkalicznych i alkalicznych
Po lewej stronie układu okresowego znajdują się dwie grupy wysoce reaktywnych metali. Z wyjątkiem wodoru pierwsza kolumna składa się z miękkich, błyszczących metali alkalicznych. Metale te mają tylko jeden elektron w powłoce walencyjnej, który jest łatwo przekazywany innemu atomowi w reakcjach chemicznych. Ze względu na ich wybuchową reaktywność zarówno w powietrzu, jak i wodzie, metale alkaliczne rzadko występują w naturze w postaci pierwiastkowej. W drugiej grupie metale ziem alkalicznych mają dwa elektrony walencyjne, co czyni je nieco twardszymi i mniej reaktywnymi. Jednak metale te wciąż rzadko występują w postaci elementarnej.
Metale przejściowe
Większość pierwiastków w układzie okresowym jest klasyfikowana jako metale. Metale przejściowe leżą na środku stołu, obejmując grupy od trzech do 12. Te pierwiastki są stałe w temperaturze pokojowej, z wyjątkiem rtęci, i mają oczekiwany metaliczny kolor i ciągliwość metali. Ponieważ powłoki walencyjne stają się tak duże, niektóre metale przejściowe są wyciągane z układu okresowego i dołączane na dole wykresu; te znane jako Lantanowce i Aktynowce. Wiele metali przejściowych w dolnej części układu okresowego jest rzadkich i niestabilnych.
Metaloidy i niemetale
Po prawej stronie układu okresowego szorstka ukośna linia dzieli metale po lewej stronie od niemetali po prawej stronie. Wzdłuż tej linii znajdują się metaloidy, takie jak german i arsen, które mają pewne właściwości metaliczne. Chemicy klasyfikują wszystkie elementy po prawej stronie tej linii podziału jako niemetale, z wyjątkiem grupy 18 po prawej stronie. Wiele niemetali jest gazowych i wszystkie wyróżniają się tendencją do pozyskiwania elektronów i wypełniania powłok walencyjnych.
Gazy szlachetne
Grupa 18, po prawej stronie układu okresowego, składa się całkowicie z gazów. Elementy te mają pełne powłoki walencyjne i nie mają tendencji ani do zdobywania, ani do utraty elektronów. W rezultacie gazy te występują prawie wyłącznie w postaci elementarnej. Chemicy klasyfikują je jako gazy szlachetne lub obojętne. Wszystkie gazy szlachetne są bezbarwne, bezwonne i niereaktywne.