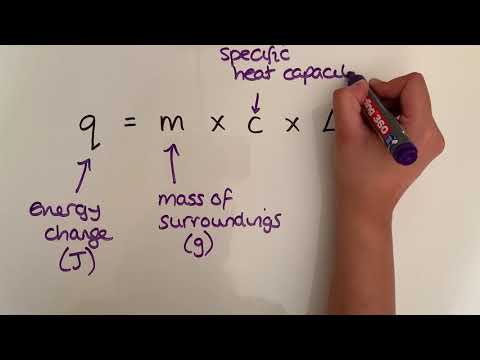
Zawartość
- TL; DR (Too Long; Didnt Read)
- Definicja entalpii
- Proste obliczanie zmiany entalpii
- Entalpia przemian fazowych
- Prawo Hessa
Zmiana entalpii reakcji to ilość ciepła pochłoniętego lub uwalnianego podczas reakcji, jeśli zachodzi ona pod stałym ciśnieniem. Obliczenia wykonujesz na różne sposoby, w zależności od konkretnej sytuacji i dostępnych informacji. W wielu obliczeniach prawo Hessa jest kluczową informacją, której należy użyć, ale jeśli znasz entalpię produktów i reagentów, obliczenia są znacznie prostsze.
TL; DR (Too Long; Didnt Read)
Możesz obliczyć zmiany entalpii za pomocą prostej formuły: ∆H = Hprodukty - Hreagenty
Definicja entalpii
Dokładna definicja entalpii (H) to suma energii wewnętrznej (U) powiększonej o iloczyn ciśnienia (P) i objętości (V). W symbolach jest to:
H = U + PV
Zmiana entalpii (∆H) wynosi zatem:
∆H = ∆U + ∆P∆V
Gdzie symbol delta (∆) oznacza „zmiana”. W praktyce ciśnienie jest utrzymywane na stałym poziomie, a powyższe równanie lepiej pokazuje:
∆H = ∆U + P∆V
Jednak dla stałego ciśnienia zmiana entalpii jest po prostu przenoszonym ciepłem (q):
∆H = q
Jeśli (q) jest dodatnia, reakcja jest endotermiczna (tj. Pochłania ciepło z otoczenia), a jeśli jest ujemna, reakcja jest egzotermiczna (tj. Uwalnia ciepło do otoczenia). Entalpia ma jednostki kJ / mol lub J / mol lub ogólnie energię / masę. Powyższe równania są naprawdę związane z fizyką przepływu ciepła i energii: termodynamiką.
Proste obliczanie zmiany entalpii
Najbardziej podstawowym sposobem obliczania zmiany entalpii jest entalpia produktów i reagentów. Jeśli znasz te ilości, użyj następującej formuły, aby ustalić ogólną zmianę:
∆H = Hprodukty - Hreagenty
Dodanie jonu sodowego do jonu chlorkowego z wytworzeniem chlorku sodowego jest przykładem reakcji, którą można obliczyć w ten sposób. Jonowy sód ma entalpię -239,7 kJ / mol, a jon chlorkowy ma entalpię -167,4 kJ / mol. Chlorek sodu (sól kuchenna) ma entalpię -411 kJ / mol. Wstawienie tych wartości daje:
∆H. = −411 kJ / mol - (2 239,7 kJ / mol −167,4 kJ / mol)
= −411 kJ / mol - (−407,1 kJ / mol)
= -411 kJ / mol + 407,1 kJ / mol = -3,9 kJ / mol
Tak więc tworzenie soli uwalnia prawie 4 kJ energii na mol.
Entalpia przemian fazowych
Kiedy substancja zmienia się z ciała stałego w ciecz, ciecza w gaz lub ciała stałego w gaz, w tych zmianach biorą udział określone entalpie. Entalpia (lub utajone ciepło) topnienia opisuje przejście z ciała stałego w ciecz (odwrotność jest minus ta wartość i nazywana entalpią topnienia), entalpia parowania opisuje przejście z cieczy w gaz (a przeciwnie jest kondensacja) i entalpia sublimacji opisuje przejście z ciała stałego w gaz (odwrotność jest ponownie nazywana entalpią kondensacji).
W przypadku wody entalpia topnienia wynosi ∆Htopienie = 6,007 kJ / mol. Wyobraź sobie, że podgrzewasz lód z 250 kelwinów, aż się stopi, a następnie podgrzewasz wodę do 300 K. Zmiana entalpii dla elementów grzewczych to tylko wymagane ciepło, więc możesz je znaleźć za pomocą:
∆H = nC∆T
Gdzie (n) to liczba moli, (∆T) to zmiana temperatury, a (C) to ciepło właściwe. Ciepło właściwe lodu wynosi 38,1 J / K mol, a ciepło właściwe wody wynosi 75,4 J / K mol. Obliczenia odbywają się w kilku częściach. Najpierw lód musi zostać podgrzany od 250 K do 273 K (tj. -23 ° C do 0 ° C). Dla 5 moli lodu jest to:
∆H = nC∆T
= 5 mol × 38,1 J / K mol × 23 K.
= 4,382 kJ
Teraz pomnóż entalpię topnienia przez liczbę moli:
∆H = n ∆Htopienie
= 5 mol × 6,007 kJ / mol
= 30,035 kJ
Obliczenia dotyczące odparowania są takie same, z wyjątkiem tego, że entalpia odparowywania zamiast topniejącej. Na koniec obliczyć końcową fazę ogrzewania (od 273 do 300 K) w taki sam sposób jak pierwszy:
∆H = nC∆T
= 5 mol × 75,4 J / K mol × 27 K.
= 10,179 kJ
Zsumuj te części, aby znaleźć całkowitą zmianę entalpii dla reakcji:
∆Hcałkowity = 10,179 kJ + 30,035 kJ + 4,382 kJ
= 44,596 kJ
Prawo Hessa
Prawo Hessa jest przydatne, gdy rozważana reakcja ma dwie lub więcej części i chcesz znaleźć ogólną zmianę entalpii. Stwierdza, że zmiana entalpii dla reakcji lub procesu jest niezależna od drogi, którą ona występuje. Oznacza to, że jeśli reakcja przekształci się w substancję w inną, nie ma znaczenia, czy reakcja zachodzi w jednym etapie (reagenty stają się natychmiast produktami), czy przechodzi przez wiele etapów (reagenty stają się pośrednikami, a następnie stają się produktami), wynikająca z tego zmiana entalpii jest taki sam w obu przypadkach.
Zazwyczaj pomaga narysować schemat (patrz Zasoby), aby pomóc ci w korzystaniu z tego prawa. Jednym z przykładów jest to, że jeśli zaczniesz od sześciu moli węgla w połączeniu z trzema atomami wodoru, spalają się, łącząc się z tlenem jako etap pośredni, a następnie tworzą benzen jako produkt końcowy.
Prawo Hessa stwierdza, że zmiana entalpii reakcji jest sumą zmian entalpii obu części. W tym przypadku spalanie jednego mola węgla ma ∆H = -394 kJ / mol (dzieje się to sześć razy w reakcji), zmiana entalpii dla spalania jednego mola wodoru wynosi ∆H = -286 kJ / mol (dzieje się to trzykrotnie), a pośrednicy dwutlenku węgla i wody stają się benzenem ze zmianą entalpii ∆H = +3,267 kJ / mol.
Weź sumę tych zmian, aby znaleźć całkowitą zmianę entalpii, pamiętając, aby pomnożyć każdy przez liczbę moli potrzebnych w pierwszym etapie reakcji:
∆Hcałkowity = 6×(−394) + 3×(−286) +3,267
= 3,267 − 2,364 - 858
= 45 kJ / mol