Zawartość
- TL; DR (Too Long; Didnt Read)
- Konfiguracje elektronowe
- Skrótowa notacja do konfiguracji
- Diagramy orbitalne
- Diagramy kropkowe
Schematy orbit elektronowych i pisemne konfiguracje informują, które orbitale są wypełnione, a które częściowo wypełnione dla dowolnego atomu. Liczba elektronów walencyjnych wpływa na ich właściwości chemiczne, a szczególna kolejność i właściwości orbitali są ważne w fizyce, więc wielu studentów musi się opanować z podstawami. Dobrą wiadomością jest to, że diagramy orbitalne, konfiguracje elektronów (zarówno w formie skróconej, jak i pełnej) oraz diagramy kropkowe dla elektronów są naprawdę łatwe do zrozumienia, gdy opanujesz kilka podstaw.
TL; DR (Too Long; Didnt Read)
Konfiguracje elektronów mają format: 1s2 2s2 2szt6 . Pierwsza liczba jest główną liczbą kwantową (n), a litera reprezentuje wartość l (liczba kwantowa momentu pędu; 1 = s, 2 = p, 3 = d i 4 = f) dla orbity, a liczba w indeksie górnym wskazuje ile elektronów jest na tej orbicie. Diagramy orbitalne używają tego samego podstawowego formatu, ale zamiast liczb dla elektronów używają strzałek ↑ i ↓, a także nadają każdej orbicie własną linię, aby reprezentować spiny elektronów.
Konfiguracje elektronowe
Konfiguracje elektronów są wyrażane za pomocą zapisu, który wygląda następująco: 1s2 2s2 2szt1. Poznaj trzy główne części tego zapisu, aby zrozumieć, jak to działa. Pierwsza liczba określa „poziom energii” lub główną liczbę kwantową (n). Druga litera mówi o wartości (l), liczbie kwantowej momentu pędu. Dla l = 1, litera to s, dla l = 2 to p, dla l = 3 to d, dla l = 4 to f, a dla wyższych liczb rośnie alfabetycznie od tego punktu.Pamiętaj, że s orbitale zawierają maksymalnie dwa elektrony, p orbitale maksymalnie sześć, d maksymalnie 10, a f maksymalnie 14.
Zasada Aufbau mówi, że orbitale o najniższej energii wypełniają się jako pierwsze, ale konkretna kolejność nie jest sekwencyjna w sposób łatwy do zapamiętania. Zobacz Zasoby dla diagramu pokazującego kolejność napełniania. Zauważ, że poziom n = 1 ma tylko s orbitale, poziom n = 2 ma tylko s i p orbitale, a poziom n = 3 ma tylko s, p i d orbitale.
Reguły te są łatwe w obsłudze, dlatego notacja dotycząca konfiguracji skandu jest następująca:
1s2 2s2 2szt6 3s2 3szt6 4s2 3d1
Co pokazuje, że całe poziomy n = 1 i n = 2 są pełne, rozpoczęto poziom n = 4, ale powłoka 3d zawiera tylko jeden elektron, podczas gdy jego maksymalna zajętość wynosi 10. Ten elektron jest elektronem walencyjnym.
Zidentyfikuj pierwiastek z notacji, po prostu zliczając elektrony i znajdując pierwiastek o pasującej liczbie atomowej.
Skrótowa notacja do konfiguracji
Zapisywanie każdego orbitalu dla cięższych pierwiastków jest żmudne, więc fizycy często używają skróconej notacji. Działa to poprzez użycie gazów szlachetnych (w skrajnie prawej kolumnie układu okresowego) jako punktu początkowego i dodanie do nich końcowych orbitali. A zatem skand ma taką samą konfigurację jak argon, z wyjątkiem elektronów na dwóch dodatkowych orbitach. Skrótowa forma jest zatem:
4s2 3d1
Ponieważ konfiguracja argonu to:
= 1s2 2s2 2szt6 3s2 3szt6
Możesz używać tego z dowolnymi pierwiastkami oprócz wodoru i helu.
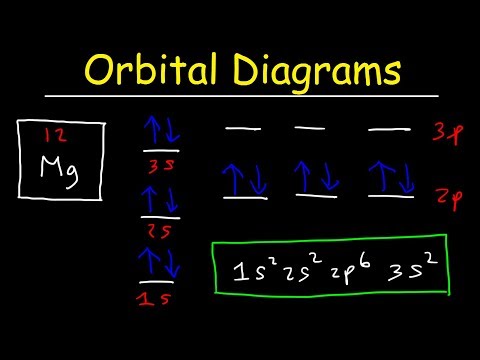
Diagramy orbitalne
Diagramy orbitalne są jak wprowadzona właśnie notacja konfiguracyjna, z wyjątkiem wskazanych spinów elektronów. Użyj zasady wykluczenia Pauliego i reguły Hunda, aby dowiedzieć się, jak wypełnić muszle. Zasada wykluczenia stanowi, że żadne dwa elektrony nie mogą mieć tych samych czterech liczb kwantowych, co w zasadzie skutkuje parami stanów zawierających elektrony o przeciwnych spinach. Reguła Hunda stwierdza, że najbardziej stabilna konfiguracja to taka z największą możliwą liczbą równoległych obrotów. Oznacza to, że pisząc schematy orbitalne dla częściowo pełnych powłok, wypełnij wszystkie elektrony spinu w górę przed dodaniem jakichkolwiek elektronów spinu w dół.
Ten przykład pokazuje, jak działają diagramy orbitalne, na przykładzie argonu:
3p ↑ ↓ ↑ ↓ ↑ ↓
3s ↑ ↓
2p ↑ ↓ ↑ ↓ ↑ ↓
2s ↑ ↓
1s ↑ ↓
Elektrony są reprezentowane przez strzałki, które również wskazują ich spiny, a notacja po lewej stronie jest standardową notacją konfiguracji elektronów. Zauważ, że orbitale o wyższej energii znajdują się na górze schematu. W przypadku częściowo wypełnionej powłoki reguła Hunda wymaga, aby były one wypełnione w ten sposób (na przykładzie azotu).
2p ↑ ↑ ↑
2s ↑ ↓
1s ↑ ↓
Diagramy kropkowe
Diagramy punktowe bardzo różnią się od diagramów orbitalnych, ale nadal są bardzo łatwe do zrozumienia. Składają się z symbolu elementu w środku, otoczonego kropkami wskazującymi liczbę elektronów walencyjnych. Na przykład węgiel ma cztery elektrony walencyjne i symbol C, więc jest reprezentowany jako:
∙
∙ C ∙
∙
A tlen (O) ma sześć, więc jest reprezentowany jako:
∙
∙∙ O ∙
∙∙
Gdy elektrony są dzielone między dwa atomy (w wiązaniu kowalencyjnym), atomy dzielą kropkę na schemacie w ten sam sposób. Dzięki temu podejście jest bardzo przydatne do zrozumienia wiązania chemicznego.