Zawartość
- TL; DR (Too Long; Didnt Read)
- Związki jonowe vs. związki kowalencyjne
- Związki jonowe w wodzie
- Związki kowalencyjne w wodzie
Związek chemiczny składa się z wielu identycznych cząsteczek utworzonych z atomów z więcej niż jednego pierwiastka, połączonych wiązaniami chemicznymi. Jednak nie wszystkie związki są tworzone jednakowo. Różne rzeczy zdarzają się związkom jonowym i związkom kowalencyjnym, gdy rozpuszczają się w wodzie.
TL; DR (Too Long; Didnt Read)
Kiedy związki jonowe rozpuszczają się w wodzie, przechodzą proces zwany dysocjacją, dzieląc się na jony, które je tworzą. Jednak gdy umieszczasz związki kowalencyjne w wodzie, zwykle nie rozpuszczają się, lecz tworzą warstwę na powierzchni wody.
Związki jonowe vs. związki kowalencyjne
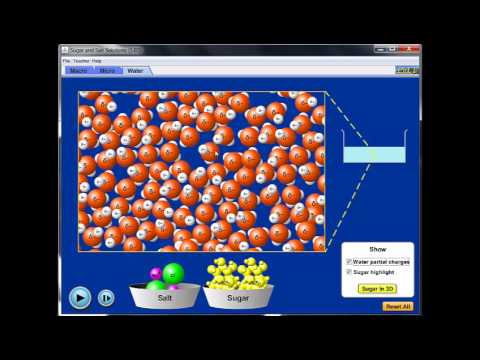
Związki jonowe to cząsteczki składające się z przeciwnie naładowanych jonów, które są jonami o ładunkach zarówno ujemnych, jak i dodatnich. Związki kowalencyjne są związanymi ze sobą niemetalami, złożonymi z dwóch elektronów wspólnych między dwoma atomami. Związki jonowe mają wysoką temperaturę topnienia i wrzenia, ale związki kowalencyjne mają stosunkowo niższą temperaturę topnienia i wrzenia. Wynika to z faktu, że związki jonowe potrzebują bardzo dużej ilości energii, aby zerwać wiązania jonowe i oddzielić ładunki dodatnie i ujemne. Ponieważ związki kowalencyjne składają się z odrębnych cząsteczek, które się nie mieszają, łatwiej się rozdzielają. Bromek sodu, chlorek wapnia i tlenek magnezu są przykładami związków jonowych, podczas gdy etanol, ozon, wodór i dwutlenek węgla są przykładami związków kowalencyjnych.
Związki jonowe w wodzie
Kiedy związki jonowe rozpuszczają się w wodzie, rozpadają się na jony, które tworzą je w procesie zwanym dysocjacją. Po umieszczeniu w wodzie jony przyciągane są do cząsteczek wody, z których każda przenosi ładunek polarny. Jeśli siła między jonami a cząsteczkami wody jest wystarczająco silna, aby zerwać wiązania między jonami, związek rozpuszcza się. Jony dysocjują i rozpraszają się w roztworze, każdy otoczony cząsteczkami wody, aby zapobiec ponownemu przyłączeniu. Roztwór jonowy zamienia się w elektrolit, co oznacza, że może przewodzić prąd.
Związki kowalencyjne w wodzie
Kiedy związki kowalencyjne rozpuszczają się w wodzie, rozpadają się na cząsteczki, ale nie na pojedyncze atomy. Woda jest polarnym rozpuszczalnikiem, ale związki kowalencyjne są zwykle niepolarne. Oznacza to, że związki kowalencyjne zwykle nie rozpuszczają się w wodzie, tworząc oddzielną warstwę na powierzchni wody. Cukier jest jednym z niewielu związków kowalencyjnych, które rozpuszczają się w wodzie, ponieważ jest polarnym związkiem kowalencyjnym (tj. Części ich cząsteczek mają stronę ujemną i stronę dodatnią), ale nadal nie rozdziela się na jony w taki sam sposób, jak związki jonowe woda. Olej jest niepolarnym związkiem kowalencyjnym, dlatego nie rozpuszcza się w wodzie.